一、项目背景及意义
急性髓系白血病(acute myeloid leukemia,AML)是一种高度异质性的血液系统恶性肿瘤,是成人中最常见的急性白血病类型,约占成人白血病的 70%。目前对成人初治患者诱导治疗的完全缓解(CR)率可达60%-80%[1],但仍有20%-40%的初治AML患者初始诱导治疗失败[2]。几十年来,尽管进行了海量临床研究,部分患者可能治愈或延长寿命,但多数患者常常结局不佳。AML患者的5年生存率仅为28.3%[3]。AML的标准化疗(蒽环类与阿糖胞苷联合)已经应用了40余年,最近一些新药的重大进展增加了我们对于AML的治疗选择。
塞利尼索(Selinexor)是一种靶向核输出蛋白1(XPO1)的口服选择性核输出蛋白抑制剂,以缓慢可逆的方式,特异性的阻抑XPO1。在临床前研究中,已证实塞利尼索可以引起肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化以及下调多种致癌蛋白水平,而阻断细胞分裂周期,并在体外和体内诱导大量实体和血液肿瘤细胞的凋亡,而正常细胞不受影响。目前,塞利尼索在AML细胞和异种移植动物模型中表现出显著的疗效。临床前试验表明,塞利尼索可以靶向白血病起始细胞(LICs),显著降低LICs数量,从而显示良好的抗白血病活性[4]。此外,鉴于塞利尼索的独特作用机制,当其与各种抗白血病的化疗药物联用时具有协同增效的作用。塞利尼索和地西他滨顺序处理AML母细胞可增强塞利尼索的抗白血病作用。研究显示,塞利尼索可以促进肿瘤抑制蛋白CDKN1A和FOXO3A的核定位,在AML细胞系OCI-AML3、MV4-11 和MOLM-13协同地西他滨显著提高抗白血病活性[5]。当塞利尼索与Topo II抑制剂联用时,塞利尼索可促进Topo IIα的核聚集并下调c-Myc等基因表达、降低DNA损伤修复蛋白水平,从而抑制DNA损伤修复并增强对Topo Ⅱ抑制剂(伊达比星、柔红霉素、依托泊苷、米托蒽醌)的敏感性,协同抑制AML细胞。临床研究表明,塞利尼索单药或联合用药安全有效。一项剂量递增的单药研究共纳入95例R/R AML患者,81例可评价患者中11例获得缓解,ORR为14%,且与无应答患者相比,中位PFS(5.1个月VS 1.3个月P=0.008)和OS(9.7个月 VS 2.7个月 P=0.01)显著改善。未观察到剂量限制性毒性(DLT),II期推荐剂量(RP2D)为60mg BIW(4周/疗程)。与单药相比,塞利尼索联合用药显示出更好的疗效。一项塞利尼索联合地西他滨治疗R/R AML患者(20例)或初治的老年AML患者(5例)研究[8]中,ORR达40%,初治老年患者的ORR达80%,缓解患者的mPFS和mOS分别是11.8个月和12.9个月,未缓解患者的mPFS和mOS分别是4.4个月和5.9个月,提示塞利尼索联合地西他滨能获得更高的ORR和更好的生存获益,尤其是新诊断的老年患者。本研究未观察到研究规定的DLT,RP2D为60mg BIW。一项在初治高危AML患者中使用塞利尼索联合阿糖胞苷和柔红霉素(标准3+7方案)的I期临床研究中,共纳入21例患者,在19例可评估疗效的患者中ORR达53%,mOS达10.3个月,患者安全性和耐受性良好,未达到最大耐受剂量(MTD),RP2D为80mg BIW。另一项研究使用塞利尼索联合氟达拉滨、阿糖胞苷、粒细胞集落刺激因子、伊达比星(FLAG-Ida)方案治疗中高危R/R AML患者,在RP2D剂量组(100mg QW)中CR/CRi率达66.7%,mOS为13.6个月,mEFS为10.6个月。
塞利尼索联合各种化疗方案治疗初治或复发难治的AML患者已在国外开展多项临床研究,显示出良好的疗效和安全性,但至今缺乏中国人群的疗效和安全性数据,尤其是联合具有中国特色的3+7方案的数据。鉴于此,山东省同心家园公益基金会拟资助医学团队开展塞利尼索联合标准3+7(IA)方案治疗初治、中高危AML患者的前瞻性、单臂、探索性临床研究,旨在探索塞利尼索联合标准3+7(IA)方案治疗初治中高危AML患者的疗效和安全性,为AML患者探索安全有效的治疗方法,推动AML患者生存治疗的改善。
二、项目概况
捐赠单位(拟):德琪(浙江)医药科技有限公司
项目名称:塞利尼索联合标准3+7(IA)方案治疗初治、中高危AML患者的前瞻性、单臂、探索性临床研究
项目期限:2023年5月10日至2025年12月31日
项目受益对象及人数:急性髓系白血病患者、22人
项目牵头专家
姓名:江浩
单位:北京大学人民医院 血液科室
职称:主任医师
简介:
北京大学人民医院血液病研究所病房主任;中华医学会血液学分会白血病淋巴瘤专业学组委员;中国医疗保健国际交流促进会血液学分会常务委员;中国老年医学会血液学分会常务委员;中国抗癌协会血液肿瘤专委会髓系肿瘤组副组长;国家突发卫生公共事件应急专家;北京市药品不良反应专家;中华医学会医疗鉴定专家;北京医学会医疗技术准入评价专家;北京市劳动能力鉴定专家
牵头专家参与工作:主要负责受试者筛选、试验关键评估、审阅检查结果、数据疑问解答等。
三、项目方案
本研究旨在评估塞利尼索联合标准3+7(IA)方案治疗初治、中高危AML患者的疗效和安全性。
研究药物的具体使用方法:
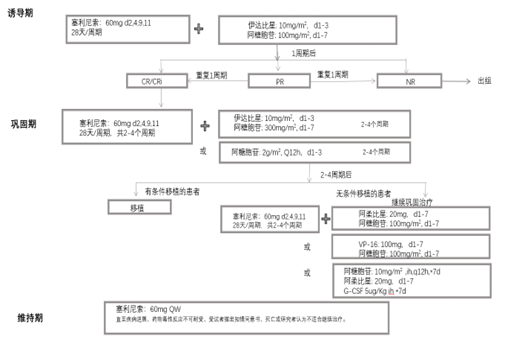
诱导期:塞利尼索60mg(d2,4,9,11,16,18)+伊达比星10mg/m2(d1、2、3),阿糖胞苷100mg/m2(d1-7),28天/周期;1个周期后评估,如获得CR/CRi,则进入巩固治疗。如获得PR,则重复一个周期后再评估。两个疗程NR则出组。
巩固期:塞利尼索60mg(d2,4,9,11),28天/周期 。联合阿糖胞苷(300mg/m2,d1-7)+伊达比星(10mg/m2,d1-3)(2-4个周期);或联合阿糖胞苷2g/m2 Q12h *3d(2-4个周期);2个周期后,有条件移植者进入移植,无条件移植者,给予塞利尼索联合阿柔比星: 20mg,d1-7, 阿糖胞苷: 100mg/m2, d1-7;或联合VP-16: 100mg,d1-7,阿糖胞苷: 100mg/m2, d1-7;或联合阿糖胞苷: 10mg/m2,ih,q12h,*7d 阿柔比星: 20mg,d1-7,G-CSF 5ug/Kg ih *7d。(2-4个周期)。上述联合方案由医生根据实际情况选择。(方案详见流程图)
维持期:塞利尼索60mg QW 维持治疗,直至疾病进展、药物毒性反应不可耐受、受试者撤出知情同意书、死亡或研究者认为不适合继续治疗。
受试者将参与筛选期、治疗期和随访期。筛选期在用药前,最多持续30天。治疗期从第1周期第1天持续直至研究治疗终止。
安全性随访:末次给药后30天进行一次安全性随访;
生存期随访:安全性随访后进入生存期随访,每12周与受试者联系一次,尽可能获得与生存期以及后续抗肿瘤治疗有关的信息。将持续长期随访直至受试者死亡或研究结束。
电话:0531-8607 9780 13901055049
邮箱:gaohang@txjy.org.cn
地址:济南市市中区经七路156号国际财富中心18层
微信:同心家园公益基金会

